Rozšiřující mikroskopie: Vidíme více než kdy dříve
Sdílet na sociálních sítích:
Nové metody rozšiřující mikroskopie umožňují detailní zobrazení buněčných membrán a proteinů s vysokým rozlišením.

V biologii vede vidění k pochopení a vědci v laboratoři profesora Edwarda Boydena v McGovern Institute for Brain Research se zaměřují na ostřejší zobrazení života. Pomocí dvou nových metod rozšiřují možnosti rozšiřující mikroskopie – techniky s vysokým rozlišením, kterou skupina představila v roce 2015 – takže vědci po celém světě mohou vidět více, když se dívají na buňky a tkáně pod světelným mikroskopem.
\n„Chceme vidět všechno, takže se neustále snažíme tuto techniku vylepšovat,“ říká Boyden, profesor neurotechnologie Y. Evy Tan na MIT. „Snímek celého života až po jeho základní stavební kameny je skutečným cílem.“ Boyden je také vyšetřovatelem Howard Hughes Medical Institute a členem Yang Tan Collective na MIT.
\nDíky novým způsobům barvení vzorků a zpracování snímků mohou uživatelé rozšiřující mikroskopie nyní vidět živé obrysy tvarů buněk na svých snímcích a přesně určit polohu mnoha různých proteinů v jediném vzorku tkáně s rozlišením, které daleko překračuje rozlišení konvenční světelné mikroskopie. Tyto pokroky, obě publikované v časopise Nature Communications s otevřeným přístupem, umožňují nové způsoby trasování tenkých výběžků neuronů a vizualizace prostorových vztahů mezi molekulami, které přispívají ke zdraví a nemoci.
\nRozšiřující mikroskopie využívá hydrogel absorbující vodu k fyzickému rozšíření biologických tkání. Poté, co je vzorek tkáně prosycen hydrogelem, je hydratován. Hydrogel při absorpci vody nabývá na objemu a zachovává relativní polohu molekul v tkáni, když je jemně od sebe odtahuje. Výsledkem je, že přeplněné buněčné komponenty se jeví oddělené a zřetelné, když se rozšířená tkáň pozoruje pod světelným mikroskopem. Tento přístup, který lze provádět pomocí standardního laboratorního vybavení, zpřístupnil zobrazování s vysokým rozlišením většině výzkumných týmů.
\nOd prvního vývoje rozšiřující mikroskopie Boyden a jeho tým neustále vylepšují tuto metodu – zvyšují její rozlišení, zjednodušují postup, vymýšlejí nové funkce a integrují ji s dalšími nástroji.
\nJedním z nejnovějších pokroků týmu je metoda zvaná ultrastrukturální membránová rozšiřující mikroskopie (umExM), kterou popsali v čísle Nature Communications ze 12. února. Díky ní mohou biologové využít rozšiřující mikroskopii k vizualizaci tenkých membrán, které tvoří hranice buněk a obklopují organely uvnitř nich. Tyto membrány, tvořené převážně molekulami zvanými lipidy, se notoricky těžko hustě značí v intaktních tkáních pro zobrazování světelnou mikroskopií. Nyní mohou vědci používat umExM ke studiu buněčné ultrastruktury a organizace v tkáních.
\nTay Shin SM '20, PhD '23, bývalý doktorand v Boydenově laboratoři a J. Douglas Tan Fellow v Tan-Yang Center for Autism Research na MIT, vedl vývoj umExM. „Naším cílem byl zpočátku velmi jednoduchý: označme membrány v intaktní tkáni, podobně jako elektronový mikroskop používá čtyřoxid osmia k označení membrán pro vizualizaci membrán v tkáni,“ říká. „Ukázalo se, že to je nesmírně těžké dosáhnout.“
\nTým nejprve musel navrhnout značku, která by membrány ve vzorcích tkání učinila viditelnými pod světelným mikroskopem. „Téměř jsme museli začít od nuly,“ říká Shin. „Opravdu jsme museli přemýšlet o základních vlastnostech sondy, která bude označovat plazmatickou membránu, a pak přemýšlet o tom, jak je začlenit do rozšiřující mikroskopie.“ To znamenalo navrhnout molekulu, která by se spojovala s lipidy tvořícími membránu a spojila ji jak s hydrogelem používaným k rozšíření vzorku tkáně, tak s fluorescenční molekulou pro viditelnost.
\nPoté, co optimalizovali protokol rozšiřující mikroskopie pro vizualizaci membrán a rozsáhle testovali a zlepšovali potenciální sondy, Shin dosáhl úspěchu jedné pozdní noci v laboratoři. Umístil rozšířený vzorek tkáně na mikroskop a viděl ostré obrysy buněk.
\nDíky vysokému rozlišení umožněnému expanzí tato metoda umožnila Boydenovu týmu identifikovat i drobné dendrity, které vyčnívají z neuronů, a jasně vidět dlouhá rozšíření jejich tenkých axonů. Tento druh jasnosti by mohl vědcům pomoci sledovat dráhy jednotlivých neuronů v hustě propojených sítích mozku, uvádějí výzkumníci.
\nBoyden označuje trasování těchto neuronálních procesů za „nejvyšší prioritu naší doby v neurovědách“. Takové trasování se tradičně silně spoléhalo na elektronovou mikroskopii, která vyžaduje specializované dovednosti a drahé vybavení. Shin říká, že protože rozšiřující mikroskopie používá standardní světelný mikroskop, je mnohem dostupnější pro laboratoře po celém světě.
\nShin a Boyden zdůrazňují, že uživatelé rozšiřující mikroskopie se mohou o svých vzorcích dozvědět ještě více, když spojí novou schopnost odhalit lipidové membrány s fluorescenčními značkami, které ukazují, kde se nacházejí specifické proteiny. „To je důležité, protože proteiny vykonávají mnoho práce buňky, ale chcete vědět, kde se nacházejí vzhledem ke struktuře buňky,“ říká Boyden.
\nZa tímto účelem už výzkumníci nemusí při použití rozšiřující mikroskopie vybírat jen několik proteinů, které chtějí vidět. Pomocí nové metody zvané multiplexní odhalování expanzí (multiExR) mohou uživatelé nyní označit a zobrazit více než 20 různých proteinů v jednom vzorku. Biologové mohou tuto metodu použít k vizualizaci sad proteinů, k zjištění, jak jsou uspořádány vzhledem k sobě navzájem, a k vytváření nových hypotéz o tom, jak by mohly interagovat.
\nKlíčem k této nové metodě, publikované 9. listopadu 2024 v Nature Communications, je schopnost opakovaně spojovat fluorescenčně značené protilátky se specifickými proteiny v rozšířeném vzorku tkáně, zobrazovat je, poté je odstranit a použít novou sadu protilátek k odhalení nové sady proteinů. Postdoktorand Jinyoung Kang doladil každý krok tohoto procesu a zajistil, aby vzorky tkání zůstaly neporušené a značené proteiny produkovaly v každém kole zobrazování jasné signály.
\nPoté, co Boydenův tým zachytil mnoho snímků jednoho vzorku, čelil další výzvě: jak zajistit, aby byly tyto snímky dokonale zarovnány, aby mohly být navzájem překryty a vytvořily konečný obrázek, který by ukázal přesné polohy všech proteinů, které byly postupně označeny a vizualizovány.
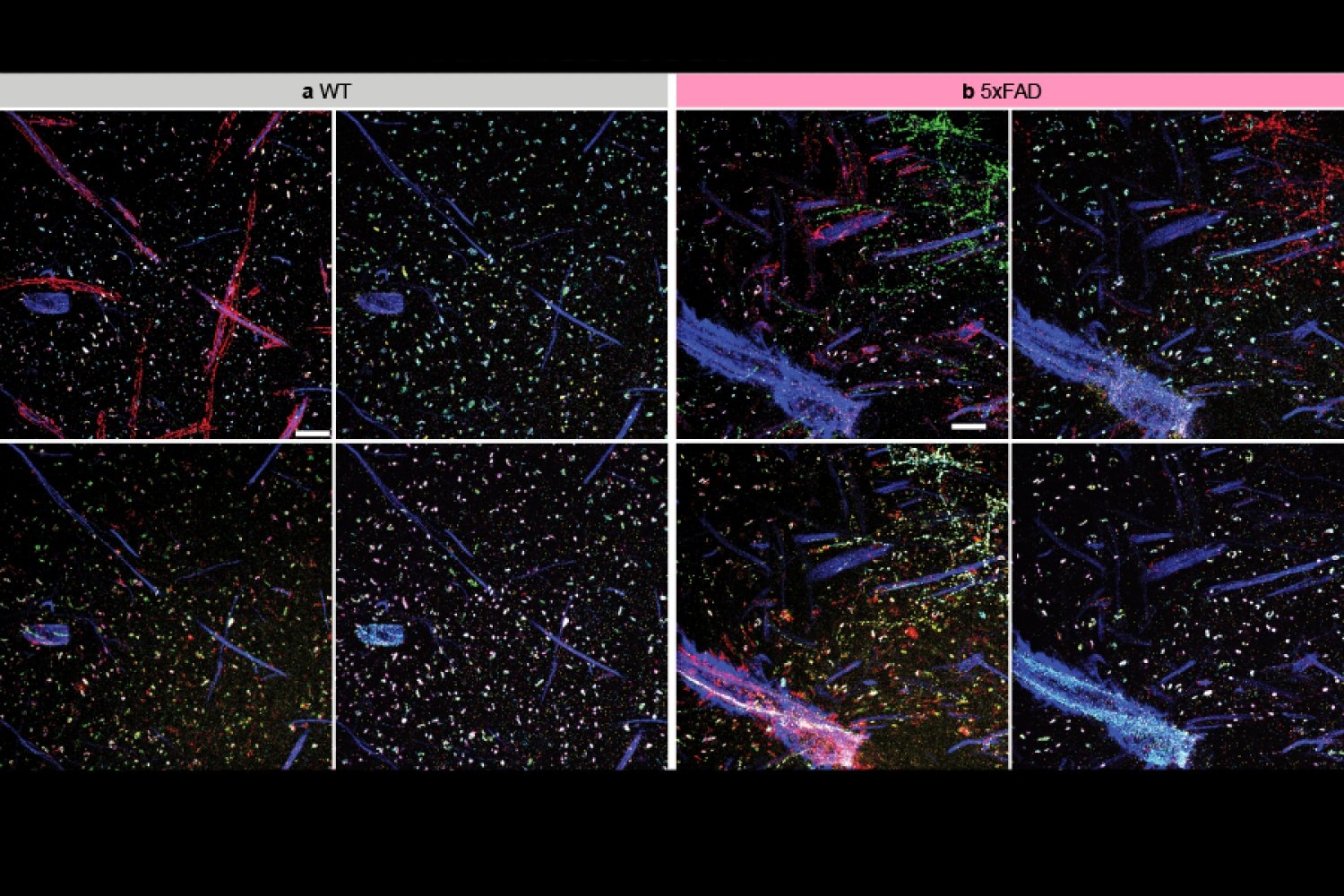
\nRozšiřující mikroskopie umožňuje biologům vizualizovat některé z nejmenších rysů buněk – ale aby se stejné rysy našly znovu a znovu během více kol zobrazování, Boydenův tým nejprve musel zaměřit větší strukturu. „Tato zorná pole jsou opravdu malá a vy se snažíte najít toto opravdu malé zorné pole v gelu, který se po rozšíření stal docela velkým,“ vysvětluje Margaret Schroeder, doktorandka v Boydenově laboratoři, která spolu s Kang vedla vývoj multiExR.
\nAby se tým dostal pokaždé na správné místo, rozhodl se označit krevní cévy, které procházejí každým vzorkem tkáně, a použít je jako vodítko. Pro umožnění přesného zarovnání se také musely v každém snímku konzistentně objevovat určité jemné detaily; k tomu tým označil několik strukturálních proteinů. Pomocí těchto referenčních bodů a přizpůsobeného softwaru pro zpracování obrazu se týmu podařilo integrovat všechny jejich snímky vzorku do jednoho, čímž se ukázalo, jak byly proteiny, které byly vizualizovány samostatně, uspořádány vzhledem k sobě navzájem.
\nTým použil multiExR k prozkoumání amyloidních plaků – abnormálních shluků proteinů, které se notoricky vyvíjejí v mozku postiženém Alzheimerovou chorobou. „Mohli jsme se podívat dovnitř těchto amyloidních plaků a zeptat se, co je uvnitř nich? A protože jsme mohli barvit mnoho různých proteinů, mohli jsme provést vysoce výkonné zkoumání,“ říká Boyden. Tým si vybral 23 různých proteinů, které se měly zobrazit na svých obrázcích. Tento přístup odhalil některá překvapení, jako je přítomnost určitých receptorů neurotransmiterů (AMPAR). „Zde je jeden z nejslavnějších receptorů v celé neurovědě, a tam se skrývá v jednom z nejslavnějších molekulárních znaků patologie v neurovědě,“ říká Boyden. Není jasné, jakou roli, pokud vůbec nějakou, hrají receptory v Alzheimerově chorobě – ale tento nález ilustruje, jak schopnost vidět více uvnitř buněk může odhalit neočekávané aspekty biologie a vyvolat nové otázky pro výzkum.
\nFinancování této práce pocházelo z MIT, Lisy Yang a Y. Evy Tan, Johna Doerra, Open Philanthropy Project, Howard Hughes Medical Institute, americké armády, Cancer Research U.K., New York Stem Cell Foundation, amerických National Institutes of Health, Lore McGovern, Good Ventures, Schmidt Futures, Samsung, MathWorks, Collamore-Rogers Fellowship, U.S. National Science Foundation, Alana Foundation USA, Halis Family Foundation, Lestera A. Gimpelsona, Donalda a Glendy Mattesových, Davida B. Emmese, Thomase A. Stockyho, Avni U. Shah, Kathleen Octavio, Good Ventures/Open Philanthropy a programu Horizont 2020 Evropské unie.
Související články
Budování důvěry ve vědu skrze dialog a empatii
Jak se příroda sama organizuje, od mozkových buněk po ekosystémy
3 otázky: Vizualizace výzkumu v éře umělé inteligence
Sdílet na sociálních sítích:
Komentáře